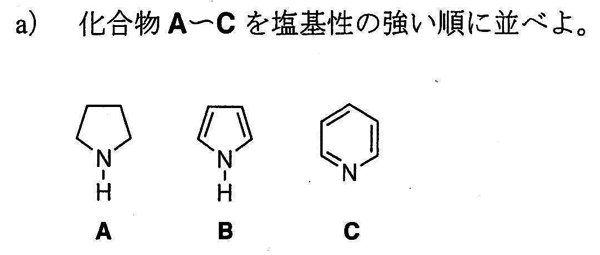
まずAはアザシクロペンタン(ピロリジン)、Bはピロール、Cはピリジンである。
答えから言うと
Aアザシクロペンタン>Cピリジン>Bピロール
となる。
まずBのピロールの塩基性が弱い理由はNが芳香族化に関与しているからである。ピロールはCから4つ、Nから2つの計6個のπ電子を持つので芳香族性を示す。この状態で安定なので塩基性は低い。以下がピロールの電子配置。
| $\rm 2p$ | $\fbox{$\uparrow \downarrow $}$ |
| $\rm sp^2$ | $\fbox{$\uparrow$}$ $\fbox{$\uparrow$}$ $\fbox{$\uparrow$}$ |
| $\rm 1s$ | $\fbox{$\uparrow \downarrow $}$ |
$\rm sp^2$の3つの不対電子で2つのCと1つのHと結合している。そして$\rm 2p$軌道の非共有電子対と炭素のπ電子で芳香族を形成しているわけである。ここへプロトンが付加するとなると、$\rm sp^2$軌道は埋まっているので残る$\rm sp$軌道へ付加するしかない。しかし$\rm 2p$は芳香族性を示すために必要なπ電子。これを使ってプロトンが付加するとπ電子がなくなる。つまり$\rm sp^2$から$\rm sp^3$軌道になってしまうわけである。となるともはや芳香族性を示せなくなる。
続いてCのピリジンを見てみる。ピリジンの電子配置は以下のとおり。
| $\rm 2p$ | $\fbox{$\uparrow$}$ |
| $\rm sp^2$ | $\fbox{$\uparrow \downarrow $}$ $\fbox{$\uparrow$}$ $\fbox{$\uparrow$}$ |
| $\rm 1s$ | $\fbox{$\uparrow \downarrow $}$ |
ご覧のとおり$\rm sp^2$軌道のうち、不対電子となっている2つの電子で隣の炭素2つとσ結合している。$\rm 2p$軌道の不対電子は他のCと同様にπ結合に使われている。残る$\rm sp^2$軌道の対になった電子は非共有電子対になる。なのでここへプロトンが付加しようとすると残ったこの非共有電子対を使うのでπ結合には何の影響も及ぼさない。ピロールとピリジンにはこのような違いがある。
Aのアザシクロペンタンは芳香族でない。ちなみに芳香族でないものを脂肪族という。ようは普通の炭素化合物。結論から言えば一般に脂肪族の方が芳香族よりも塩基性が強い。それはアルキル基が電子供与基だからである。芳香族は共役により電子密度が均一化されている(それゆえ安定なのだが)。対してアザシクロペンタンではアルキル基が電子を供与してくれるためNの電子密度が高くなる。そうなると求電子的な付加がしやすくなるので結果アザシクロペンタは塩基性が高くなる。
以上の強さの比較よりAアザシクロペンタン>Cピリジン>Bピロールとなる。
0 件のコメント:
コメントを投稿