有機化学中心にまとめ。
・第一級アルコール→アルデヒド→カルボン酸
・第二級アルコール→ケトン
・第三級アルコール→酸化されない
有機化学において不飽和といえばそれは二重結合や三重結合(不飽和結合)を持っていることである。不飽和結合の定義としては隣接する原子間で2価以上で結合している結合のことなのでつまり二重結合や三重結合となる。
一般に酸性度の強さは
カルボン酸>フェノール>アルコール
となる。基本的に共役塩基の安定性が高いほど酸性度は高い。つまり共鳴があると酸性度が高い。カルボン酸の共役塩基は2つの酸素間で共鳴が起こるのでとても安定。フェノールはベンゼン環内で共鳴が起きるのでこれも安定。しかし酸素どうして共鳴するほうが安定なので安定性ではカルボン酸の方が高い。そしてアルコールはπ電子がなく、また酸素原子が1つしかないので共鳴しない。
誘起効果とは、ある原子が結合を介して別の原子に静電気的な効果を与えることである。例えば電気陰性度が高い原子があるとアルコールが電離した時、Oにある電子が引き寄せられる。
共鳴効果はR効果とも呼ばれる。
共役ジエンとは二重結合が単結合一つに隔てられているジエンのこと。1-3ブタジエンなど。二重結合が単結合2つ以上に隔てられてしまうと非共役ジエンという。
Diels-Alder(ディールスアルダー)反応は共役ジエンとアルケンの混合物を加熱すると不飽和の6員環を生成する反応のこと。
・塩基性の強さ
$\rm F^->Cl^->Br^->I^-$
・求核性の強さ
$\rm I^->Br^->Cl^->F^-$
・脱離能の高さ
$\rm I^->Br^->Cl^->F^-$
電子吸引性と電子供与性の両方を持つ場合、どちらの効果がより大きく現れるかは状況による。まず、共鳴効果>電気陰性度であることを考える。共鳴効果が起こらない場合であれば電気陰性度により電子吸引基として働く。しかしベンゼン環など共鳴効果が起こる場合には先の共鳴効果>電気陰性度により共鳴効果が大きく現れる。となると電子吸引性が隠れ電子供与基として働くわけである。
ただしハロゲンは逆になる。ハロゲンの場合誘起効果>共鳴効果となり電子吸引性の方が大きくなるので注意。このため例えばベンゼンの置換反応では不活性化を示すが共鳴効果によりオルト-パラ配向性を示すという変わり種。
幾何異性体であれば燃焼熱が小さいほど安定である。
| $\rm S_N1$ | $\rm S_N2$ | $\rm E1$ | $\rm E2$ | |
| 機構 | 一分子求核置換反応 | 二分子求核置換反応 | 一分子脱離反応 | 二分子脱離反応 |
| 反応速度 | 基質の濃度のみで決まる | 基質と試薬の両方の濃度によって決まる | 基質の濃度のみで決まる | 基質と試薬の両方の濃度によって決まる |
| 生成物 | エナンチオマーが等量ずつ出来上がるラセミ体(実際は完全なラセミ体になるわけではないらしい) | 立体が反転(ワルデン反転)する | ||
| 反応性 | 第一級>第二級>第三級 | 第三級>第二級>第一級 | 第三級>第二級>第一級 | 第三級>第二級>第一級 |
アルカン $C_nH_{2n+2}$
アルケン $C_nH_{2n}$
アルキン $C_nH_{2n-2}$
シクロアルカン $C_nH_{2n}$
ジクロアルケン $C_nH_{2n-2}$
不飽和度は水素不足指数とも呼ばれる。公式は
\begin{align}
不飽和度 = \frac{2C+2-H-X+N}{2}
\end{align}
となる。Cは炭素の数、Hは水素の数、Xはハロゲン原子の数、Nは窒素の数。Hはヒドロキシ基OHのHもカウントする。酸素などの16族原子はカウントしない。
不飽和度は構造からも計算できる。二重結合は1、三重結合は2、環構造は1となるのでそれぞれ単純に数を数えて和を撮ればよい。環同士のくっつき方や環中の二重結合などそういった類のものは一切考える必要はなく単純に二重結合、三重結合、環の数を数えれば良い。例えばバンコマイシンは二重結合が23個、環が10個あるので不飽和度は33と計算できる。
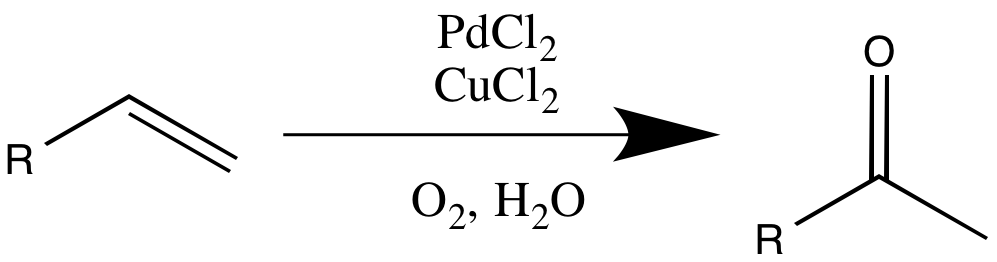
ワッカー酸化は塩化パラジウムと塩化銅を触媒としてアルケンをカルボニル化合物へ酸化する化学反応。基本的に内部アルケンは反応性が低く末端アルケンしか反応しない。
ニトロ化はベンゼンと、濃硝酸と濃硫酸の混酸の反応で起こる。ニトロニウムイオンが求電子試薬として働いてベンゼンに付加しカルボカチオン中間体を生成する。ここからプロトンが脱離してニトロ化が完了する。
化学式中に点"$\cdot$"があるのは水和物であることを示している。水和物とは結晶中に水分子が取り込まれているもの。
0 件のコメント:
コメントを投稿